一、氢气的工业制法
在工业上通常采用如下几种方法制取氢气:
一是将水蒸气通过灼热的焦炭(碳还原法),得到纯度为75%左右的氢气;
二是将水蒸气通过灼热的铁,得到纯度在97%以下的氢气;
三是由水煤气中提取氢气,得到的氢气纯度也较低;
四是电解水法,制得的氢气纯度可高达99%以上;
其中,电解水制氢技术主要有四种:
1、碱性水电解(AEC),
2、质子交换膜水电解(PEM),
3、固体氧化物水电解(solid oxide electrolyticcells,SOEC),
4、固体聚合物电解质水电解(SPE)。
二、电解水制氢原理
1、电解水原理
在一些电解质水溶液中通入直流电时,分解出的物质与原来的电解质完全没有关系,被分解的是作为溶剂的水,原来的电解质仍然留在水中。例如硫酸、氢氧化钠、氢氧化钾等均属于这类电解质。
在电解水时,由于纯水的电离度很小,导电能力低,属于典型的弱电解质,所以需要加入前述电解质,以增加溶液的导电能力,使水能够顺利地电解成为氢气和氧气。
氢氧化钾等电解质不会被电解,现以氢氧化钾为例说明:
(1)氢氧化钾是强电解质,溶于水后即发生如下电离过程:
KOH⇔K++ OH -
于是,水溶液中就产生了大量的K+和OH-。
(2)金属离子在水溶液中的活泼性不同,可按活泼性大小顺序排列如下
K>Na>Mg>Al>Mn>Zn>Fe>Ni>Sn>Pb>H>Cu>Hg>Ag>Au
在上面的排列中,前面的金属比后面的活泼。
(3)在金属活泼性顺序中,越活泼的金属越容易失去电子,否则反之。
从电化学理论上看,容易得到电子的金属离子的电极电位高,而排在活泼性大小顺序前的金属离子,由于其电极电位低,所以难以得到电子从而变成原子。
H+的电极电位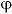 H= -1.71V,而K+的电极电位
H= -1.71V,而K+的电极电位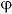 H = -2.66V,所以,在水溶液中同时存在H+和K+时,H+将在阴极上首先得到电子而变成氢气,而K+则仍将留在溶液中。
H = -2.66V,所以,在水溶液中同时存在H+和K+时,H+将在阴极上首先得到电子而变成氢气,而K+则仍将留在溶液中。
(4)水是一种弱电解质,难以电离。
而当水中溶有KOH时,在电离的K+周围则围绕着极性的水分子而成为水合钾离子,而且因K+的作用使水分子有了极性方向。
在直流电作用下,K+带着有极性方向的水分子一同迁向阴极,这时H+就会首先得到电子而成为氢气。
2、水的电解方程
在直流电作用于氢氧化钾水溶液时,在阴极和阳极上分别发生下列放电反应。
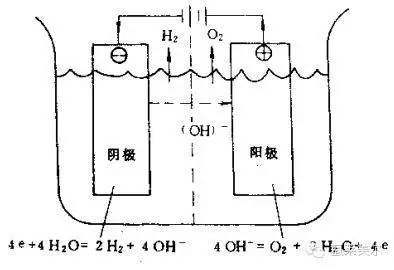
(1)阴极反应。电解液中的H+(水电离后产生的)受阴极的吸引而移向阴极,接受电子而析出氢气,其放电反应为:4e +4H₂O=2 H₂↑+4OH-
(2)阳极反应。电解液中的OH-受阳极的吸引而移向阳极,最后放出电子而成为水和氧气,其放电反应为:4OH- =2H₂O+O₂↑+4e
阴阳极的总反应式为:2H₂O=2 H₂↑+ O₂↑
三、电解电压
在电解水时,加在电解池上的直流电压必须大于水的理论分解电压,以便能克服电解池中的各种电阻电压降和电极极化电动势。
电极极化电动势是阴极氢析出时的超电位与阳极氧极出时的超电位之和。因此,水电解电压U可表示为:U=U0+IR+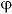 H+
H+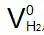 o
o
式中U0——水的理论分解电压,V;
I——电解电流,A;
R——电解池的总电阻,Ω;
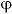 H——氢超电位,V;
H——氢超电位,V;
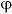 0——氧超电位,V。
0——氧超电位,V。
从能量消耗的角度看,应该尽可能地降低电解电压。下面讨论影响电解电压的几个因素:
(1)水的理论分解电压U0。
热力学的研究得出:原电池所做的最大电功等于反应处自由能变的减少,即:-△Gm0=nFE0
式中△Gm0 ——标准状态下电池反应的吉布斯自由能变,J/mol
n——反应中的电子转移数;
F——法拉第常数,96500C/mol;
E0——标准状态下反应的标准电动势,V。
在生成水的化学反应中,自由能变为-474.4kJ/mol,即△Gm0=-474.4kJ/mol
2H2(g)+O2(g)=2H2O (1)
这是一个氧化还原反应,在两个电极上的半反应分别为:阳极O2+4H++4e=2H2O ,阴极2H2=4H++4e
电子转移数n=4,由△Gm0 =-nFE0得- 474.4×103 = - 4×96500E0
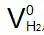
可见,在0.1MPa和25℃时,U0=1.23V;它是水电解时必须提供的最小电压,它随温度的升高而降低,随压力的升高而增大,压力每升高10倍,电压约增大43mV.
(2)氢超电位和氧超电位。
影响氢超电位和氧超电位的因素很多。首先,电极材料和电极的表面状态对它的影响较大,如铁、镍的氢超电位就比铅、锌、汞等低,铁、镍的氧超电位也比铅低。
与电解液接触面积越大或电极表面越粗糙,产生的氢超电位和氧超电位就越小。
其次,电解时的电流密度增大,超电位会随之增大,温度的上升也会引起超电位的增大。
此外,超电位还与电解质的性质、浓度及溶液中的杂质等因素有关,如在镍电极上,稀溶液的氧超电位大于浓溶液的氧超电位。
为了降低氢超电位和氧超电位,可以采取一些方法。如提高工作温度及采用合适的电极材料等。
此外,适当增大电极的实际表面积或使电极表面粗糙,都可在不同程度上降低电极电阻和超电位,从而达到降低工作电压的目的。
(3)电阻电压降。
电解池中的总电阻包括电解液的电阻、隔膜电阻、电极电阻和接触电阻等,其中前两者为主要因素。
隔膜电阻电压降取决于材料的厚度和性质。采用一般的石棉隔膜,电流密度为2400A/m2时,隔膜电阻上的电压降约为0.25~0.30V,当电流密度再增大时,该电压降还会增大到0.5V左右。
电解液的导电率越高,电解液中的电压降就越小。
对电解液来说,除要求其电阻值小以外,还要求它在电解电压下不分解;不因挥发而与氢、氧一并逸出;对电解池材料无腐蚀性;当溶液的pH值变化时,应具有一定的缓冲性能。
多数的电解质在电解时易分解,不宜在电解水时采用。硫酸在阳极生成过硫酸和臭氧,腐蚀性很强,不宜采用。而强碱能满足以上要求,所以工业上一般都以KOH或NaOH水溶液作为电解液。
KOH的导电性能比NaOH好,但价格较贵,在较高温度时,对电解池的腐蚀作用亦较NaOH的强。过去我国常采用NaOH作电解质,但是,鉴于目前电解槽的材料已经能抗KOH的腐蚀,所以,为节约电能,已经普遍趋向采用KOH溶液作为电解液。
此外,在电解水的过程中,电解液中会含有连续析出的氢、氧气泡,使电解液的电阻增大。电解液中的气泡容积与包括气泡的电解液容积的百分比称作电解液的含气度。含气度与电解时的电流密度,电解液粘度、气泡大小、工作压力和电解池结构等因素有关。
增加电解液的循环速度和工作压力都会减少含气度;增加电流密度或工作温度升高都会使含气度增加。在实际情况下,电解液中的气泡是不可避免的,所以电解液的电阻会比无气泡时大得多。当含气度达到35%时,电解液的电阻是无气泡时的2倍。
降低工作电压有利于减少电能消耗,为此应采取有效措施来降低氢、氧超电位和电阻电压降。一般情况下,在电流较小时,前者是主要因素;而在电流较大时,后者将成为主要因素。
电解槽在高工作压力下运行时,电解液含气度降低,从而使电解液电阻减小,为此已经研制出可在3MPa压力下工作的电解槽。但是工作压力也不宜过高,否则会增大氢气和氧气在电解液中的溶解度,使它们通过隔膜重新生成水,从而降低电流效率。
提高工作温度同样可以使电解液电阻降低,但随之电解液对电解槽的腐蚀也会加剧。如温度大于90℃时,电解液就会对石棉隔膜造成严重损害,在石棉隔膜上形成可溶性硅酸盐。
为此,已经研制出了多种抗高温腐蚀的隔膜材料,如镍的粉末冶金薄片和钛酸钾纤维与聚四氟乙烯粘结成的隔膜材料,它们可以在150℃的碱液中使用。为了降低电解液的电阻,还可以采取降低电解池的电流密度,加快电解液的循环速度,适当减小电极间距离等方法。
四、制氢设备的制氢量衡算和电能消耗
1、法拉第定律
电解水溶液制氢时,在物质量上严格遵守法拉第定律:各种不同的电解质溶液,每通过96485.309C的电量,在任一电极上发生得失1 mol电子的电极反应,同时与得失1 mol电子相对应的任一电极反应的物质量亦为1mol。
F=96485.309C/mol称为法拉第常数,它表示每摩尔电子的电量。在一般计算中,可以近似取F=96500C/mol。根据拉第定律,可以得到下式:
M=kIt=kQ
式中 k——表示1h内通过1A电流时析出的物质量,g/(A•h)
I——电流,A;
t——通电时间,h;
m——电极上析出的物质的质量,g;
Q——通过电解池的电荷量,A•h。
由于库仑单位很小,所以工业上常用的电荷量单位是安培•小时,它与法拉第常数F的关系是:1F=96500/3600=26.8 A•h
2、制氢量衡算
从法拉第定律可知,26.8A•h电荷量能产生0.5mol的氢气,在标准状态下,0.5mol氢气占有的体积是11.2L,则1A•h电荷量在一个电解小室的产气量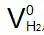 应为
应为
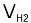 =11.2L/26.8A•h=0.418L/(A•h)=0.000418 m³
=11.2L/26.8A•h=0.418L/(A•h)=0.000418 m³
如果考虑电流效率,那么每台电解槽每小时的实际产氢量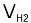 应为:
应为:
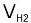 =0.000418mltηm³
=0.000418mltηm³
式中 m——电解槽的电解小室数,
I——电流,A;
t——通电时间,h;
η——电流效率,%。
同样地,可以计算出氧气的产气量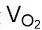 ,它正好是氢气产气量的1/2。
,它正好是氢气产气量的1/2。
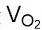 =0.000209 mltηm³
=0.000209 mltηm³
3、电能的消耗
电能消耗W与电压U和电荷量Q成正比,即:W=QU
根据法拉第定律,在标准状况下,每产生1m3的氢气的理论电荷量Q0为:
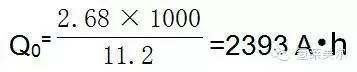
因此,理论电能消耗W0为:
W0= Q0U0=2393×1.23=2943W•h
式中:U0为水的理论分解电压,U0=1.23V。
在电解槽的实际运行中,其工作电压为理论分解电压的1.5~2倍,而且电流效率也达不到100%,所以造成的实际电能消耗要远大于理论值。目前通过电解水装置制得1m3氢气的实际电能消耗为4.5~5.5KW•h。
4、电解用水消耗
电解用水的理论用量可用水的电化学反应方程计算:
2H2O=2H2↑+O2↑
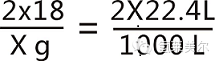
式中:x为标准状况下生产1m3氢气时的理论耗水量,g;
22.4L为1mol氢气在标准状况下的体积。
x/18=1000/22.4 x=804g
在实际工作过程中,由于氢气和氧气都要携带走一部分水分,所以实际耗水量稍高于理论耗水量。目前生产1m3氢气的实际耗水量约为845~880g。
原文始发于微信公众号(艾邦氢科技网):电解水制氢的原理
 艾邦氢能产业链通讯录,目前有2200人加入,如亿华通、清极能源、氢蓝时代、雄韬、氢牛、氢璞、爱德曼、氢晨、喜马拉雅、明天氢能、康明斯、新源动力、巴拉德、现代汽车、神力科技、中船712等等,可以按照标签筛选,请点击下方关键词试试
资料下载:
艾邦氢能产业链通讯录,目前有2200人加入,如亿华通、清极能源、氢蓝时代、雄韬、氢牛、氢璞、爱德曼、氢晨、喜马拉雅、明天氢能、康明斯、新源动力、巴拉德、现代汽车、神力科技、中船712等等,可以按照标签筛选,请点击下方关键词试试
资料下载:

