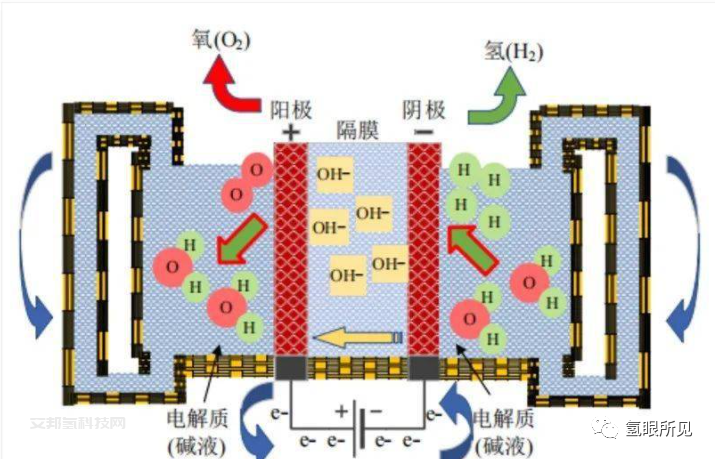
一、纯水的电离度
1.纯水是一种很弱的电解质,常温下只有少量带正电荷的氢离子和带负电荷的氢氧根离子。水的离子积为K水=1*10-14,即水中氢离子与氢氧根离子浓度的乘积。
2.所以电解水的过程需要有电解质的参与才能形成有效电解。
3.电解质的大体分为强电解质和弱电解质;从状态上区分可以是液态或者固态电解质等;根据酸碱性可以区分为酸性电解质和碱性电解质等。
二、电解质的选择
1.不同的电解质溶液往往会有不同的电解产物。我们在选择电解液时,首先要考虑到电解时能够出纯净的氢气,此外还必须考虑到电解质的导电率稳定性、经济性、超电压影响以及对设备的腐蚀性等。
各种电解液具有不同的导电率。在强电解质中,由于盐类导电率比酸、碱的导电率都要小,所以一般不用盐类作为电解液。而酸类如硫酸,它的导电率比较高,稳定性也比较好,在空气中不变质,其价格也便宜,同时,气体析出、分离比较容易,且析出的氧气气泡大,上升分离快。但是如果把硫酸作为电解液,那硫酸对电解槽会产生强烈的腐蚀,盐酸、硝酸也是如此。因此,在工业上不宜采用酸类作电解质。
2. 工业上一般采用碱性溶液做电解质,如氢氧化钠以及氢氧化钾。当然也有其他形式的电解质如全氟磺酸电解质、磷酸电解质等。
3. 为了保证电解槽的正常运行,降低电能消耗和延长检修周期,电解液应保持一定的纯度。如果在电解液中存在大量的碳酸盐,那会降低溶液中的氢氧根离子浓度,影响导电率;此外碳酸盐容易从碱液中结晶析出堵塞气、液道。在碱性溶液中铁离子很容易生成氢氧化物沉淀;此外铁离子在直流电的作用下也能够沉积到阴极表面变成铁粉把活化层覆盖住,影响电极反应严重时还可能造成极间短路。氯离子的存在会强烈地活化金属,使铁镍电极容易溶解;另外,氯根的存在容易使隔膜表面产生黑斑影响离子渗透,降低隔膜的使用寿命。当氯离子达到一定浓度时在直流电的作用下,它也可能到阳极上放电而产生氯气。
三、电解电压
1.电极电位:
锌、铅、铜三种金属来说,锌最活泼,即失去电子的能力最强,铅次之,而铜最不活泼。通过一系列实验,按照金属取代能力递减的顺序,确定了金属的活动性顺序表:
钾(K)、钠(Na)、钙(Ca)、镁(Mg)、铝(Al)、锰(Mn)、锌(Zn)、铬(Cr)、铁(Fe)、镍(Ni)、锡(Sn)、铅(Pb)、氢(H)、铜(Cu)、(Hg)、银(Ag)、铂(Pt)、金(Au)。
2.耐斯特方程
电对的电极电位不仅取决于电对的本性,而且还决定于溶液的浓度和温度。电极电位(E)与浓度和温度关系可以用奈斯特(1864-1942)方程式表示:
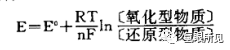
式中:
E--标准电极电位,这时离子浓度为mol/L如果是气体,则它的分压为0.1MPa;
R--气体常数; T--绝对温度;
n--还原型物质转变为氧化型物质时所失去的电子数; F--法拉第常数;
〔氧化型物质)--氧化型物质浓度;[还原型物质)--还原型物质浓度。
将各常数代入,当温度为25℃时,奈斯特方程式为:

如果还原型物质转化为氧化型物质的方程式中有不等于1的系数时,则在奈斯特方程式中应以此系数为对应浓度的方次数。
根据奈斯特方程式,我们可以计算出任意两种电极所构成的电池的电动势,判断氧化还原反应能否进行以及进行的限度等。
3.水的分解电压
3.1 水电解时,电解槽的两极外加电压从零开始逐渐增加,当所加的电压很小时,几乎没有电流通过电路,也看不出任何电解现象。当电压升高到一定数值以后,克服了两极产生的反电动势,这时电流发生了显著的变化。我们把水电解顺利进行时所必需的最小电压叫作水的分解电压。不同的物质具有不同的分解电压,分解电压越大,说明该物质越难分解,分解时所需要的电能也就越多。
3.2我们也可以根据反应的自由能来计算水的理论水解电压(也可以透过逆电动势来计算所得):
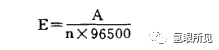
式中:
A氢氧反应的自由能236504j;
n-电极反应中电子得失的数目;96500--法拉第常数。
将以上数值代入上式:E=2365042x96500=1.23V
3.3实际分解电压
下表列出了几种电解液(浓度为-mol/L)的实际和理论分解电压。

这个实际分解电压和理论分解电压的差值,告诉我们这样一个事实:由于电流的通过,两极的电极电位出现了偏离于平衡的现象,这种和未通过电流时的电极电位有差异的现象叫做极化作用。
4. 极化作用
极化作用的原因很复杂,根据极化产生的原因不同,通常可分为浓差极化和超电压。
4.1浓差极化
在电解时电极表面的离子浓度常常和溶液中的离子浓度有差别,例如,电解NaOH溶液在负极上发生:
2H++2e→H2
如果溶液中的氢离子来不及补充上去,那负极附近的氢离子浓度将小于溶液中氢离子的浓度。正极上发生:
4OH -- 4e→2H0+02:
同样,正极附近的氢氧根离子浓度将低于溶液中氧氧根离子浓度。由于这种浓度差别,结果使实际电化学反应的电极电位大于按溶液浓度所计算的可逆电极电位,这种由于离子扩散迟缓而引起的极化称为浓差极化。
强烈地搅动电解液或升高温度,可以减低浓差极化。在电解过程中,由于电解液的温度较高,且电解液是循环的,所以这种极化作用影响不大,可以忽略不计。
4.2 超电压
由于电化反应迟缓而引起的极化称为超电压。当电极上产生气体时超电压就特别明显。例如,在水电解过程中,氢离子的放电可分为几个步骤进行:
①H3O+从溶液扩散到电极附近;
②H3O+从电极附近溶液中移到电极上;
③H3O+在电极上取得电子变成原子;
④氢原子结合为氢分子;
⑤氢分子成气泡在电极上析出。
在上述反应中,其中①⑤两步不能影响反应速率,至于②③④三步究竟哪一步反应最慢各人的意见并不一致,迟缓放电理论认为③最慢,而复合理论则认为④即吸附在电极上的氢原子结合成为氢分子的步骤为最慢,而引起超电压。
至于氧的超电压,那更为复杂,且再现性小。一般认为形成高价氧化物如:NiO2、Ni2O3,等而引起的。
影响超电压的因素很多,如电极材料、电极表面状态、电流密度及电解液的性质、温度、浓度等。
4.2.1电极材料的关系:
我们选择电极材料是根据材料对于电解质的稳定性对气体的超电压及材料的经济性。由于铂(Pt)钯(Pd)和金(Au)都是价格昂贵的金属,所以工业上就不可能用它们来制造电极。
现在生产中一般用镀一层无光泽镍的软铁作为阳极,这是因为在氧气存在的情况下,铁在碱性溶液中阳极极化时稳定性不够容易生成亚铁酸盐而被腐蚀;又氧气在镍上的超电压比较小且铁与镍的电极电位相当接近一旦镀层被破坏,它们之间的电化腐蚀比较缓慢。也有直接用镍薄片或镍丝网作阳极从标准电极电位可以看出电解时作为阳极的金属镍镀层比溶液中的氢氧根离子更容易失去电子而进入溶液但实际上镍并不溶解,这是因为在碱性溶液中镍被钝化的缘故。
由于氢在铁上的超电压是比较小的,而铁在碱溶液中又是非常稳定的,所以工业上就直接用软铁作为阴极为了进一步降低氢的超电压现在一般在铁阴极上还要加镀二硫化三镍活化层。
除了电极材料的性质影响超电压外,电极的表面状态对超电压也有很大影响。在粗糙表面上的超电压要比在光滑表面上的超电压小。这是因为粗糙电极的真正工作面积要比光滑电极表面积大得多。例如三种不同加工方法的电极:抛光铁片砂纸磨光铁片和喷砂(丸)磨光铁片它们的表面积之比为1:6:14它们的超电压大小就不同。当电流密度为1000A/m时,氢在抛光铁片上的超电压就要比在喷砂铁片上的超电压大0.2V。
4.2.2和电流密度的关系
氢氧的超电压随着电流密度的增加而增加,但在不同的阶段上,增加的速度不等。当电流密度比较小的时候增加的速度比较快,但当增加到一定程度后,增加的速度就很慢而趋向某一数值。所以在实际运行时应设法降低电解槽的电流密度(仅仅从降低超电压的角度来看)。
4.2.3和其他的关系:
超电压除了与电极、电流密度有关外还与电解液的性质、温度和浓度有关,它是随着电解液的温度或浓度的升高而下降。
如果不考虑浓差极化,那么,以铂为电极电解0. 1mol/LNaOH水溶液的实际分解电压是1.77V。
5.电解液的电压损耗
电解液的电压损失与电解液的电导率、电解液的有效截面积成反比,与两极间的距离成正比下面我们就这些因素分别进行讨论。
5.1电解液的电导率与电解液的浓度和温度相关,压力影响不大。
A、电导率与温度的关系
电解液的电导率是随着溶液温度升高而增加的,这是因为温度升高时液体的粘度减小,使离子的扩散速度增加,从而使电极反应加快;另外,随着温度的升高气体的超电压也将降低。温度每升高1℃平均减少电压0.25%。但是如果温度过高,那排出的气体将带走大量的水汽和碱液并且电解液对设备的腐蚀也将增加。因此电解液的温度也不宜过高一般控制在80-85℃。在压力下电解时,为了降低电耗,电解液温度可适当提高,一般控制在90℃左右。
B、电导率与浓度的关系
电导率最大的数值是随着温度的提高而趋向较浓溶液的方向,因此在电解中必须按照电解过程控制的温度来选择电解液的浓度。当电解温度在60~65℃时,一般采用浓度为20~22%的氢氧化钠作电解液,或采用30%左右的氧氧化钾;当电解温度控制在80~85℃时一般采用25%左右的氢氧化钠作电解液,或采用32%左右的氢氧化钾。
如果碱液浓度过高,那不仅会增加电耗,而且对隔膜和胶垫增加腐蚀,太浓时甚至可能析出碱液晶体,堵塞液道管和气道管造成电解小室内液位下降,电压升高,最后造成电弧打火事故。如果浓度过低例如氢氧化钾浓度低于200g/L时,那不仅会增加电耗,而且会使金属的钝性减弱,增加对设备的腐蚀,并会降低气体的纯度。当氢氧化钾的浓度减低至120g/L以下时,设备将出现强烈腐蚀,因此,在电解生产过程中,需定期测量碱液密度,及时调整碱液浓度,使其保持在规定的工艺范围内。
5.2电解液的有效截面积
KOH在不同温度下的电导 电解液的有效截面积与电解槽的极板大小和电解液中的含气度有关。电极板面积的增大,不仅使极板本身反应面积增大,而且使电解液的有效截面积也相应变大,使电导增加。
电解液中的含气度是以气泡的容积与电解液总容积的百分比来表示。由于电解时电解液被上升的气泡充满,从而减小了电解液的有效截面积,使电流通过电解液时电阻增加。
含气度与电解槽的结构、电流密度、电解液温度和粘度,气泡大小、碱液循环等有关。通常通过改变电解槽结构使得气泡更容易排出;加速电解液循环;加大压力(一般放在4MPa以内,再增大效果不明显。另增大压力也会提高电解液的沸点)。另降低电流密度可降低超电压,但是会影响产气量。
5.3阴阳两极之间的距离。
金属的导电能力比溶液的导电能力大得多,缩短两极间的距离,即缩短电解液导电的距离,这对于增加电解液的电导,降低电解电压意义很大。但两极间距离过近,将提高电解液的含气度,引起气体纯度下降,另外,如果电极板有凹凸不平,距离过近容易在槽内引起短路打火。在实际生产中,阴阳电极间的距离一般控制在5mm左右。
随着制作技术的不断提高和新型电解槽的不断出现阴阳两极之间的距离正在缩小,特别是板框结合式的电解槽的出现,其网状阴阳极分别紧压在隔膜两侧,它们和隔膜一起是靠带有许多乳状突起的相邻主极板顶紧(这种方式易导致隔膜破损,造成内泄漏,还可以有更好的方式)。
6.电解槽内电压的衡算

当电解槽材料良好操作正常时主要是理论分解电压、超电压和电解液电压损失,其他可以忽略不计。根据现有电解槽的结构、材料和操作条件槽内阴、阳极之间的实际电压为理论分解电压的1.5~2倍,即极间电压为1.8~2.5V。
四、能量衡算和物料衡算
1. 电能消耗和电流效率
电能消耗(W)与电压(V)电量(Q)成正比:
W=V·Q
根据法拉第定律在标准状况下制取1.0m3氢和0.5m3氧的理论电量为:

因此,理论电能消耗(W)为:
W=VQ=1.23x2390=2940w·h=2.94kw·h
因为电解槽电压为理论电压的15~2倍所以在标准状况下每生产1.0m3氢和0.5m3实际电能消耗为4.5-6kw·h。
理论电量Q与实际消耗电量Q比值称为电流效率η用百分率来表示:
η=Q/Qx100%
以上我们已经知道在电解水制氢、氧的电化反应中只有H+和OH-参加反应,没有其它离子发生副反应析出的氢和氧也没有在电解液中参加次级反应,因此,电流效率主要决定于气体分隔的完善程度和有无电力漏失。目前生产中所使用的电解槽因隔膜性能较好,极间绝缘和槽体对地绝缘也良好寄生电解现象轻微所以这些损失很小,现代电解槽电流效率接近100%。
2.热量衡算
我们已经知道水电解时实际电能消耗约是理论电能消耗的1.5-2倍,这也就是该输入电能中的60-80%用于水的分解其余部分用来克服内电阻而转变为热量(Q)。电解槽内放出的总热量为下列各个部分之和:

当电流强度不变,电解过程及周围介质温度也不变时q2、q3、q4和q5;也是一定的,因此要维持电解槽一定的运行温度,主要取决于冷却水的控制。
3.水的消耗
每产生1.0m3氢和0.5m3氧纯理论耗水量为804g,但在实际生产过程中纯水的消耗量还要高些这是因为在电解过程中有一部分水以水蒸汽状态被氢,氧气带出气体出口温度愈高饱和蒸汽压便愈大那被带走的水蒸汽量也就愈大;气体出口压力愈高,电解液浓度愈大,则被带走的水蒸汽量就愈小。一般电解设备在标准状况下每产生1.0m3氢和0.5m3氧实际消耗纯水量在0.9L左右。
原文始发于微信公众号(氢眼所见):电解水制氢读书笔记之【电解水制氢理论篇】
 艾邦氢能产业链通讯录,目前有2200人加入,如亿华通、清极能源、氢蓝时代、雄韬、氢牛、氢璞、爱德曼、氢晨、喜马拉雅、明天氢能、康明斯、新源动力、巴拉德、现代汽车、神力科技、中船712等等,可以按照标签筛选,请点击下方关键词试试
资料下载:
艾邦氢能产业链通讯录,目前有2200人加入,如亿华通、清极能源、氢蓝时代、雄韬、氢牛、氢璞、爱德曼、氢晨、喜马拉雅、明天氢能、康明斯、新源动力、巴拉德、现代汽车、神力科技、中船712等等,可以按照标签筛选,请点击下方关键词试试
资料下载:


