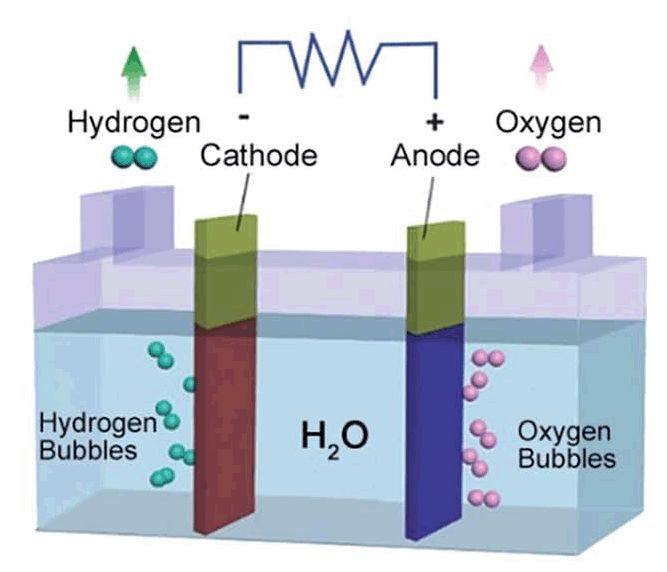
电解水时,质子或水合氢离子在阴极得到电子,发生还原反应,生成氢气析出,该过程简称为氢还原反应(Hydrogen Evolution Reaction,HER)。HER反应在不同介质中反应过程也有所不同,从分子层面理解其详细的机理有助于我们加深对电解水的整体认识,对于一线的科研工作者来说,还需熟悉表征该反应的相关参数指标。
本文深度科普HER反应的机理,并对各主要表征参数展开介绍,帮助大家从本质上加深对电解水析氢的理解。

-反应机理-
在酸性介质中,氢气的生成需要两步,首先是Volmer过程(式1),即水合氢离子结合电子生成活性氢原子H*吸附在活性物质表面(M)。第二步则有两种方式,取决于H*生成与消耗的平衡关系:当H*的生成速率大于消耗速率时,活性物质表面H*过量,此时两个H*易于直接结合,生成氢气,称为Tafel过程(式2);另一种是Heyrovsky过程(式3),即当H*的生成速率小于消耗速率时,一个H*与质子和电子结合,生成氢气。
H3O+ + e- + M → MH*+ H2O (Volmer) (1)
2MH* → 2M + H2(Tafel) (2)
MH* + H3O+ + e- → M + H2+H2O (Heyrovsky) (3)
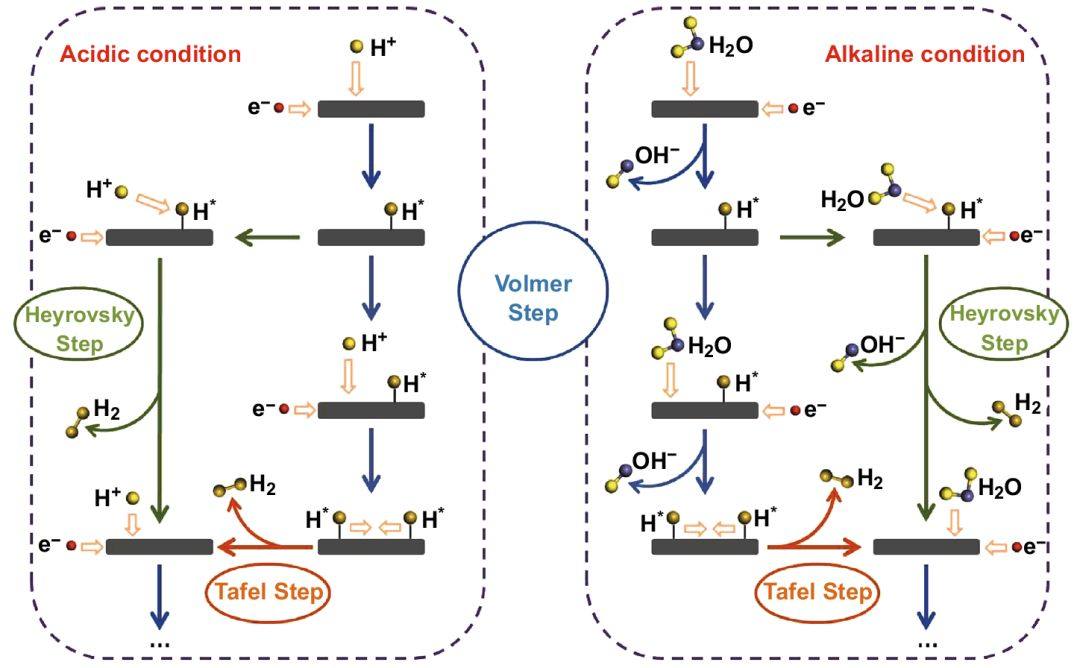
酸性(左)和碱性(右)介质中的HER机理
在碱性介质中,质子浓度大幅降低,因此Volmer过程和Heyrovsky过程发生变化,Volmer过程中,水和电子结合,生成吸附氢原子和氢氧根离子(式4);Heyrovsky过程则是吸附氢原子结合一个水分子和一个电子,生成氢气和氢氧根离子(式5)。
M + H2O + e- → MH* + OH-(Volmer) (4)
MH* + H2O + e- → M + H2 + OH-(Heyrovsky) (5)

-表征参数-
E = Eθ - RT/nF·ln CRb/COa (6)
R——气体常数,8.314 J·mol-1·K-1;
F——法拉第常数,8.314 J·mol-1·K-1;
具体到氢还原反应,公式(6)变为以下形式(式7):
E = Eθ -RT/nF·ln(1/c(H+)2) (7)
理论上,外加电势超过反应的平衡电极电势反应即可发生,但实际上由于反应活化能的存在,需要额外的外加电势才能使反应发生并持续进行,即过电势η(式8):
η = E测 - E (8)
氢还原反应的标准电极电势规定为0,即Eθ = 0。值得注意的是,测试所得极化曲线通常会进行电势的校正,即去除溶液电阻所导致的电势差。此外,还需根据所选参比电极的标准电极电势(vs. RHE),将电势转化为对氢电极电势,经转换后的对氢电极电势的计算方程式如下(式9):
ηRHE = E测 - E + E参 - IR (9)
ηRHE = E测 + E参 - Eθ + RT/nF·ln(1/c(H+)2)- IR (10)
为实现低成本高效率的电解水制氢,需要在低过电势下达到高电流密度。通过测试采集催化材料的极化曲线,可得到电流密度随电势变化的信息,目前普遍以电流密度达到-10mA/cm2 (η-10)所需的过电势作为指标,衡量材料的催化HER性能。
| 塔菲尔斜率 |
在实际应用中,电流密度与过电势的关系可用Butler-Volmer来表达(式11):
j = j0 {exp[(1-α)nFη/RT]- exp(-αnFη/RT)} (11)
式中: j0——交换电流密度 (mA/cm2);
α——对氧化反应和还原法反应偏向程度的不对称系数。
对于氢还原反应,在高过电势下,方程简化为Tafel公式(式12):
j » - j0 exp(-αnFη/RT) (12)
构造描述电流密度与过电势的函数,将此函数定义为Tafel斜率b为(式13):
b = 2.303RT/αF (13)
根据该函数可知,b越小,电流密度随过电势增大而增大的越快,因此可作为反映材料的催化性能的指标。
此外,在HER中,Tafel过程和Heyrovsky过程往往共同发生。可根据塔菲尔斜率判断反应的动力学过程,推断决速步骤:当Volmer过程为决速步骤时,b接近118 mV/decade;Tafel过程为决速步骤时,b接近39 mV/decade;Heyrovsky过程为决速步骤时,b接近29 mV/decade。
| 氢吸附吉布斯自由能 |
由反应机理可知,无论在酸性还是碱性介质中,H*作为产氢的中间产物参与了所有过程的反应,因此活性物对H*的吸附能 (△GH*) 对材料的催化HER性能有着重大影响。当以交换电流密度来反映材料的催化性能,以交换电流密度和△GH*为坐标轴作图,即可得到“火山图”。该图表明,铂(Pt)的△GH*接近于0,具有最大的交换电流密度,表明Pt具有最好的催化HER性能。位于Pt右侧的材料对H*的吸附过弱,难以稳定生成H*,而位于左侧的材料对H*吸附过强,产生的H2难以脱附,会封闭活性位点,因此,随着△GH*向左右两侧逐渐远离0,交换电流密度也随之减小。该结果证明△GH*接近于0的催化材料由于对H*的吸附力适中,最适合作为HER高效催化剂。
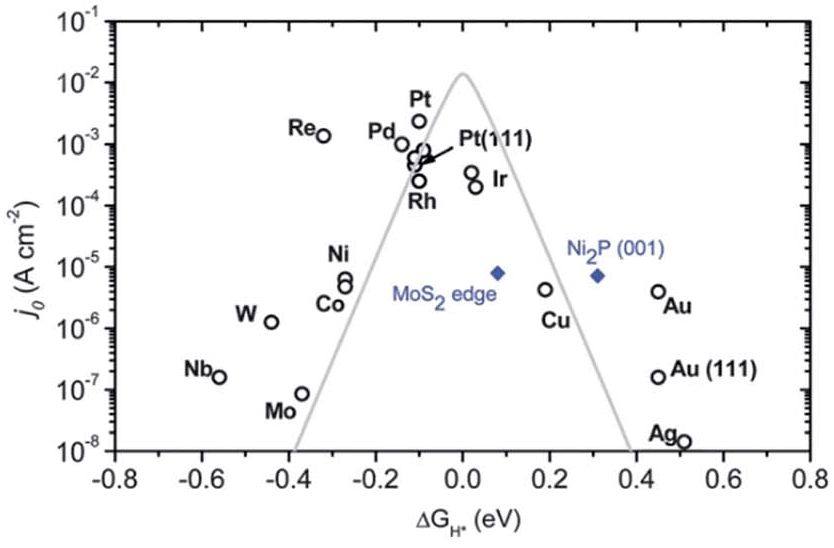
交换电流密度与△GH*的火山图
| 稳定性 |
持续稳定催化的能力是检验催化剂的重要指标。检验方法主要有两种,一是在恒电压下测试电流随时间的变化曲线(I-t曲线),通常持续测试12 h以上,曲线显示电流无明显衰退,则认为催化剂的稳定性良好;另一种是测试初始极化曲线和持续工作一定时间后的极化曲线,对比前后曲线的差异,如测试后曲线显示性能无明显衰退,则认为催化剂的稳定性良好。
图灵科创官网:http://www.sztlkc.com/
原文始发于微信公众号(图灵科创):电解水氢还原反应机理及有关参数








